대웅제약 ‘나보타’, 미국 3상 임상결과 SCI급 국제학술지 게재
대웅제약은 지난 21일 나보타(Prabotulinumtoxin A, 미국명 Jeuveau)의 미국 3상 임상결과가 국제학술지 ‘더마톨로직 서저리(Dermatologic Surgery)’에 게재됐다고 25일 밝혔다.
나보타는 지난 2월 미국 식품의약국(FDA)의 판매허가를 획득한 대웅제약의 자체개발 보툴리눔 톡신 제제로, 미국에서 654명의 미간주름 환자를 대상으로 3상 임상(EV-001, EV-002)을 두차례 진행한 바 있다.
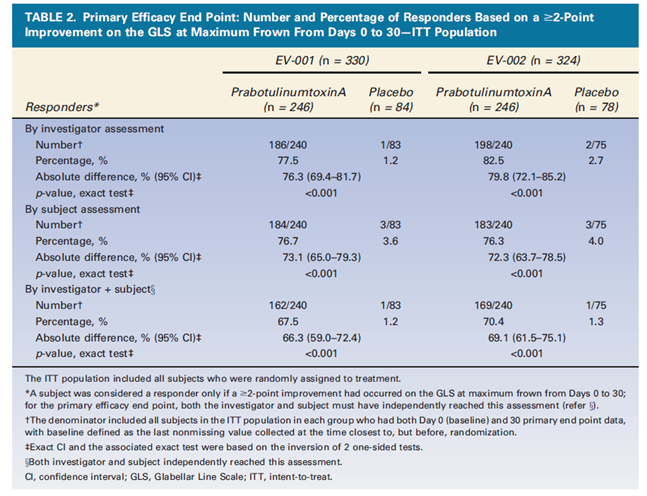
해당 연구는 만 18세 이상의 중등증 또는 중증 미간주름 환자를 대상으로 나보타와 위약을 동일 용량으로 1회 투여하고, 일정시점 이후 4단계 미간주름스케일(Glabellar Line Scale, GLS)을 활용해 주름개선 효과를 확인하는 이중맹검 방법으로 진행됐다.
연구 결과에 따르면 두 차례 임상에서 시술 후 30일째, 총 4단계 GLS 중 연구자와 피험자가 동시에 2단계 이상 주름이 개선됐다고 응답한 비율이 각각 67.5%와 70.4%로 나타났다. 이는 위약군에서의 해당 응답 비율인 1.2%, 1.3%와 극명한 차이를 보여, 위약 대비 나보타의 우수한 주름개선 효과를 입증했다.
시술 후 120일, 150일째에도 해당 응답 비율이 위약 대비 우월하게 나타났으며, 이러한 결과는 미간주름 시술 후 증상개선을 평가하는 GAIS(Global Aesthetic Improvement Scales)에서도 동일하게 나타났다. 약물 관련 심각한 이상사례는 보고되지 않아 나보타의 안전성도 입증됐다.
미국 3상 임상의 연구 책임자이자 이번 논문의 제1저자인 케네스 비어 (Kenneth Beer) 마이애미 대학 교수는 “이번 SCI급 논문 게재는 나보타의 안전성과 유효성을 다시 한번 입증한 것으로, 향후 보툴리눔 톡신 제품 선택의 기준이 될 수 있을 것으로 기대한다”고 말했다.
나보타는 올 봄 미국 시장에 진출할 예정이다. 또한 유럽의약품청(EMA)의 허가심사 절차도 순조롭게 진행되고 있어 상반기 내 판매 승인 여부가 가시화될 전망이다.
©(주) 데일리안 무단전재 및 재배포 금지
 대웅제약 ‘나보타’, 미국 3상 임상결과 SCI급 국제학술지 게재. ⓒ대웅제약
대웅제약 ‘나보타’, 미국 3상 임상결과 SCI급 국제학술지 게재. ⓒ대웅제약
