복제약 제조 허가 강화에 가격 인하까지
정부 정책 실패…“그때는 맞고 지금은 틀리다?”
복제약 제조 허가 강화에 가격 인하까지
정부 정책 실패…“그때는 맞고 지금은 틀리다?”
 약 제조. ⓒ연합뉴스
약 제조. ⓒ연합뉴스
보건복지부가 내놓은 제네릭(복제약) 약가 차등제를 두고 실효성 논란이 일고 있다. 3년 뒤 위탁 제네릭의 허가가 전면 금지되면 생동시험 수행 여부에 따라 복제약 가격을 차등 부여하는 방안이 무용지물이 된다는 이유에서다.
업계에서는 “조삼모사(朝三暮四)식 행정”이라는 비판도 나온다. 사실상 이번 약가 개편안이 이미 허가가 난 복제약을 겨냥한 게 아니냐는 것이다.
지난 27일 복지부가 발표한 약가제도 개편방안에 따르면 직접생동과 등록된 원료의약품(DMF)을 사용하는 요건을 모두 충족한 복제약에 한해 오리지널 약가 대비 53.55%를 보전해준다. 복제약이 두 요건 중 한 가지라도 만족시키지 못하면 오리지널 약가 대비 45.52%로 약가가 내려간다.
2가지 요건 모두 충족하지 못하면 복제약 약가는 오리지널약 대비 38.69%%까지 깎인다. 복지부는 신규 등재하는 복제약에 대해 올 하반기부터 이 제도를 적용키로 했다. 앞서 등재된 복제약은 3년의 유예기간을 거쳐 기준 요건 충족에 따른 차등제가 적용된다.
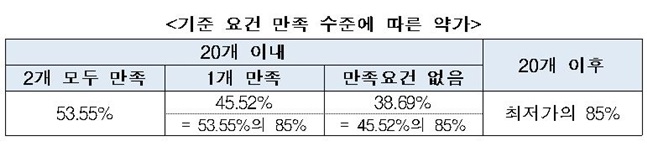 기준 요건 만족 수준에 따른 약가. ⓒ보건복지부
기준 요건 만족 수준에 따른 약가. ⓒ보건복지부
건강보험 등재 순서 21번째부터는 2개 기준 충족 여부와 상관 없이 앞선 복제약 가격 최저가의 85% 수준에서 약가가 산정된다. 22번째 복제약은 21번째 복제약 가격의 85%로 매겨지는 식이다.
이렇게 되면 늦게 복제약을 내놓는 제약사는 원가에도 못 미치는 수준에서 가격을 책정할 수밖에 없다. 기존에는 가격 차등화 없이 모든 복제약이 오리지널 가격의 53.55%를 약가로 인정받았기 때문에 늦게라도 복제약 시장에 뛰어들 수 있었다.
이와 더불어 식품안전의약처도 기존 공동생동에 참여하는 제약사 수에 제한이 없던 제도를 폐지하고 ‘1+3’이라는 개편안을 내놨다. 앞으로는 공동생동에는 직접생동하는 1개 업체 외 최대 3개사까지만 위탁생동을 할 수 있다. 식약처는 이 제도를 3년간 시행한 후 2023년부터는 공동생동을 폐지하겠다고 못 박았다.
원료의약품 등록에 따른 차등 요건도 마찬가지다. 식약처 ‘원료의약품 등록에 관한 규정'을 보면 2017년 12월부터 ’의약품동등성 확보가 필요한 의약품‘ 즉 모든 복제약 의약품 원료의약품의 DMF 등록이 전면 의무화됐다. 이때부터 허가받은 복제약은 모두 DMF 등록 원료의약품만 사용했다는 의미다.
식약처 규정에 따르면 2023년부터는 위탁복제약 허가가 전면금지되고 원료 DMF도 의무화되기 때문에 복지부의 약가 차등제가 무의미하게 된다. 약가 차등제의 두 가지 요건이 복제약 제조의 필수 요건이 되기 때문에 일등도 꼴등도 없는 셈이다. 기등재된 복제약들만 3년의 유예기간을 벌었고, 2023년 이후엔 기존 복제약 가격이 차등 인하되는 수순을 밟는다.
정부의 일관성 없는 정책에 대한 날 선 비판도 이어지고 있다.
제약업계 관계자는 “정부가 2012년에 제약산업 활성화를 위해 공동 생동시험을 도입하며 복제약 생산을 장려할 땐 언제고 이제 와서 복제약 난립을 문제 삼아 공동생동을 폐지하고 가격을 낮추려 한다”면서 “오락가락하는 정부의 정책을 이해하기 어렵다”고 말했다.
한 중소제약사 관계자는 “복제약 매출이 80%에 육박하는 제약사들이 많은데 제네릭 상품을 대체할 대안을 찾지 못하면 망할 수밖에 없다”며 “오리지널 약을 많이 보유한 외국제약사나 복제약을 직접생동하고 제조해온 대형제약사들 배만 불릴 것”이라고 우려했다.
©(주) 데일리안 무단전재 및 재배포 금지
0
0
기사 공유

이은정 기자 (eu@dailian.co.kr)
기사 모아 보기 >
댓글
0
/ 150
-
최신순
-
찬성순
-
반대순
0 개의 댓글 전체보기
 실시간 랭킹뉴스
실시간 랭킹뉴스
댓글 쓰기